Silahkan jawab pertanyaan dibawah ini :
Organisasi Profesi Guru
Presiden Jokowi memberi hormat kepada Guru-Guru se Indonesia.
Tema Gambar Slide 2
Deskripsi gambar slide bisa dituliskan disini dengan beberapa kalimat yang menggambarkan gambar slide yang anda pasang, edit slide ini melalui edit HTML template.
Tema Gambar Slide 3
Deskripsi gambar slide bisa dituliskan disini dengan beberapa kalimat yang menggambarkan gambar slide yang anda pasang, edit slide ini melalui edit HTML template.
Rabu, 04 Juli 2018
RPP KIMIA K13 Kelas X Semester 1
RENCANA
PELAKSANAAN PEMBELAJARAN
A. Identitas
1. Sekolah :
SMA Muhammadiyah
2. Mata Pelajaran : Kimia
3. Kelas/Semester : X/Ganjil
4. Materi Pokok : Teori Pasangan Elektron Kulit
Valensi (VSEPR) dan Teori Domain elektron
5. Alokasi Waktu : 4 JP (2 x pertemuan)
A.
Kompetensi Inti
1. Menghayati dan mengamalkan ajaran agama yang dianutnya.
2. Menghayati dan mengamalkan perilaku a. jujur, b. disiplin, c. santun, d. peduli (gotong royong, kerjasama, toleran, damai), e. bertanggung jawab, f. responsif, dan g. pro-aktif, dalam berinteraksi secara efektif sesuai dengan perkembangan anak di lingkungan, keluarga, sekolah, masyarakat dan lingkungan alam sekitar, bangsa, negara, kawasan regional, dan kawasan internasional.
3. Memahami, menerapkan, menganalisis dan mengevaluasi pengetahuan faktual, konseptual, prosedural, dan metakognitif pada tingkat teknis, spesifik, detil, dan kompleks berdasarkan rasa ingin tahunya tentang a. ilmu pengetahuan, b. teknologi, c. seni, d. budaya, dan e. humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
4. Menunjukkan keterampilan menalar, mengolah, dan menyaji secara: a. efektif, b. kreatif, c. produktif, d. kritis, e. mandiri, f. kolaboratif, g. komunikatif, dan h. solutif, dalam ranah konkret dan abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah, serta mampu menggunakan metoda sesuai dengan kaidah keilmuan.
B.
Kompetensi Dasar dan
Indikator Pencapaian Kompeten
KD3
|
KD4
|
3.6 Menerapkan Teori Pasangan
Elektron Kulit Valensi (VSEPR) dan Teori Domain elektron dalam menentukan
bentuk molekul
|
4.6
Membuat model bentuk molekul
dengan
menggunakan bahan-bahan
yang
ada di lingkungan sekitar atau
perangkat
lunak komputer
|
IPK
|
IPK
|
3.6.1
Peserta didik dapat
menentukan PEB dan PEI berdasarkan Teori Domain electron
3.6.2
Peserta didik dapat menjelaskan
PEB dan PEI berdasarkan Teori Domain electron
3.6.3
Peserta didik dapat
menentukan bentuk molekul berdasarkan Teori Pasangan Elektron Kulit Valensi
(VSEPR) dan Teori Domain electron
3.6.4
Peserta didik dapat
menjelaskan Teori Pasangan Elektron Kulit Valensi (VSEPR) dan Teori Domain
electron
3.6.5
Peserta didik dapat
menerapkan Teori Pasangan Elektron Kulit Valensi (VSEPR) dan Teori Domain
electron
|
4.6.1 Peserta didik dapat membuat salah satu model molekul dengan
menggunakan bahan-bahan yang ada di lingkungan sekitar
|
B.
Tujuan
Pembelajaran
Melalui model pembelajaran discovery learning, peserta didik dapat mampu menerapkan dan membuat
model molekul Teori Pasangan Elektron Kulit Valensi (VSEPR) dan Teori Domain elektron
dalam menentukan bentuk molekul dengan mengembangkan nilai karakter berpikir kritis , kreatif (kemandirian), kerjasama (gotong
royong) dan kejujuran (integritas)
.
C.
Materi Pembelajaran
BENTUK MOLEKUL
Fakta:
Contoh: molekul
CH4
Atom C sebagai
atom pusat mempunyai 4 PEI, sehingga rumusnya AX4 dan bentuk molekulnya
tetrahedral.
Konsep :
Bentuk molekul
berkaitan dengan susunan ruang atom-atom dalam molekul. Berikut ini bentuk geometri dari beberapa molekul.
Teori VSEPR (Valence Shell Electron Pair
Repulsion)
Teori domain
elektron merupakan penyempurnaan dari teori VSEPR.Domain elektron berarti
kedudukan elektron atau daerah keberadaan elektron,dengan jumlah domain
ditentukan sebagai berikut (Ralph H. Petrucci, 1985).
a. Setiap
elektron ikatan (baik itu ikatan tunggal, rangkap, atau rangkap tiga) berarti
1 domain.
b. Setiap
pasangan elektron bebas berarti 1 domain.
Prosedur :
Langkah-langkah meramalkan
geometri molekul berdasarkan teori VSEPR:
Pasangan elektron
terdiri dari:
Pasangan Elektron
Ikatan (PEI)
Pasangan Elektron
Bebas (PEB)
Bentuk
molekul/struktur ruang dipengaruhi oleh gaya tolak menolak pasangan elektron.
Adapun urutan
gaya tolak-menolak dapat digambarkan sebagai berikut:
tolakan (PEB –
PEB) > tolakan (PEB – PEI) > tolakan (PEI – PEI)
Adanya gaya
tolak-menolak ini menyebabkan atom-atom yang berikatan membentuk struktur ruang
tertentu dari suatu molekul.
Langkah-langkah
yang dilakukan untuk meramalkan geometri molekul adalah:
a. Menentukan
tipe molekul.
b.Menggambarkan
susunan ruang domain-domain elektron di sekitar atom pusat yang memberi tolakan minimum.
c. Menetapkan
pasangan terikat dengan menuliskan lambang atom yang bersangkutan.
d. Menentukan
geometri molekul setelah mempertimbangkan pengaruh pasangan elektron bebas.
Contoh
:
Molekul air, H2O:
Langkah 1: Tipe
molekul adalah AX2E2 (4 domain).
Langkah 2:
Susunan ruang pasangan-pasangan elektron yang memberi tolakan minimum adalah
tetrahedron.
Langkah 3:
Menentukan pasangan terikat dengan menuliskan lambang atom yang terikat (atom
H).
Langkah 4:
Molekul berbentuk V (bentuk bengkok).
D.
Pendekatan/
Model/Metode Pembelajaran
1.
Pendekatan : Saintifik
2.
Metode : Diskusi kelompok, tanya jawab, dan penugasan
3.
Model : Discovery learning
E.
Media/Alat dan Bahan
Pembelajaran
1.
Media/Alat : Audio-Video
bentuk
molekul, Lembar Kerja, LCD, media belajar
internatif (animasi)
2. Bahan ajar:
· Bahan presentasi, video mengenai PEB dan PEI
· Modul
F.
Sumber Belajar
Unggul
Sudarmo. Buku Kimia SMA kelas X. Erlangga. 2016.
Kalstum
Siti, dkk. Kimia 2 Kelas XI SMA dan MA. Pusat Perbukuan Departemen Pendidikan
Nasional. Jakarta 2009.
Utami
Budi, dkk. Kimia untuk SMA/MA Kelas XI
Program IPA. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta 2009.
Vidio
Link : https://www.youtube.com/watch?v=igq4KjrkzuE&t=117s
Vidio
Link : https://www.youtube.com/watch?v=Sfj9SUPluDM
G.
Langkah-Langkah
Pembelajaran
Pertemuan Pertama (2 JP)
No
|
Tahap/
Sintak Model
|
Kegiatan
|
Nilai-nilai
karakter
|
Estimasi Waktu
|
1
|
Pendahuluan
|
a.
Peserta didik berdoa sebelum pembelajaran dimulai,
dilanjutkan mengecek kehadiran peserta didik.
b.
peserta didik melakukan
literasi memulai pelajaran.
c.
Siswa memperhatikan apersepsi tentang ikatan
kimia
d.
Siswa mendengarkan tujuan yang akan dicapai berkaitan dengan Teori Pasangan Elektron Kulit Valensi (VSEPR) dan Teori
Domain electron dikaitkan dengan manfaatnya
dalam kehidupan sehari-hari;
e.
Peserta didik mendengarkan garis besar
cakupan materi Teori Pasangan
Elektron Kulit Valensi (VSEPR) dan Teori Domain electron.
f.
Peserta didik mendengar penjelasan metode pembelajaran dan teknik penilaian yang akan
digunakan saat membahas materi sifat
larutan berdasarkan daya hantarnya.
|
Religiositas
(kegiatan berdoa)
Gotong royong
|
|
2
|
Kegiatan Inti
|
|||
a.
Stimulus
|
Peserta
didik memperhatikan stimulus berupa tayangan video mengenai PEB
dan PEI.
|
|||
b. Identifikasi Masalah
|
Peserta didik mengidentifikasi kejadian dalam video tersebut.
Pada kegiatan ini diharapkan muncul pertanyaan-pertanyaan kritis dari peserta didik/guru, antara lain:
1)
Apakah itu PEB dan PEI?
2)
Mengapa berbeda jumlah PEB dan PEI?
|
Kemandirian
(berfikir kritis dan kreatif)
|
||
c. Pengumpulan Data
|
1)
Peserta didik
dengan teliti mencari dan mengumpulkan
data/informasi tentang PEB dan PEI melalui studi literatur;
2)
Peserta
didik mengerjakan table data yang ada pada SKPD
3)
Peserta didik diminta untuk menjawb pertanyaan mengenai PEB dan PEI.
(Guru memberikan informasi kepada peserta didik
bahwa waktu telah habis, kegiatan pembelajaran akan dilanjutkan pada
pertemuan berikutnya)
|
Integritas,
Gotong-royong,
|
||
3
|
Penutup
|
a.
Memfasilitasi
peserta
didik untuk mereview pembelajaran yang telah dilaksanakan.
b.
Melaksanakan penilaian untuk mengetahui ketercapaian indikator
c.
Memberikan
tugas kepada peserta didik berupa perhitungan PEB dan PEI,
d.
Berdoa bersama dan memberi salam
|
Kemandirian,
Religiositas)
|
H.
Penilaian
I.
Penilaian
1.
Teknik
Penilaian:
a.
Penilaian
Sikap : Observasi/pengamatan/Jurnal
b.
Penilaian
Pengetahuan : Tes Tertulis
c.
Penilaian
Keterampilan : Produk/Portofolio
Bentuk
Penilaian:
a.
Observasi : lembar pengamatan aktivitas peserta
didik
b.
Tes tertulis : uraian dan
lembar soal
c.
Unjuk kerja : lembar
penilaian presentasi
d.
Portofolio : laporan
e.
Produk : model bentuk molekul
2.
Instrumen
Penilaian (terlampir)
J.
Lampiran Pendukung RPP
- Teori Domain Elektron
Struktur ruang suatu molekul dapat ditentukan
berdasarkan adanya Pasangan Elektron Ikatan (PEI) dan Pasangan Elektron Bebas
(PEB) pada kulit terluar atom pusat molekul tersebut. Oleh karena antar
elektron tersebut memiliki muatan yang sejenis, maka akan terjadi gaya
tolak-menolak. Pasangan elektron tersebut akan cenderung meminimumkan gaya
tolak tersebut dengan cara membentuk suatu susunan tertentu ( berupaya untuk saling menjauh ). Teori yang
dipakai untuk menjelaskan struktur ruang molekul adalah Teori Tolakan
Pasangan Elektron Kulit Valensi ( VSEPR
= Valence Shell Electron Pair Repulsion ).
Berdasarkan jumlah PEB dan PEI, maka bentuk dasar
molekul dapat dikelompokkan menjadi :
1)
Linear ( PEI +
PEB = 2 ) 4) Bipiramida trigonal ( PEI + PEB = 5
)
(sudut
ikatan = 1800) (sudut ikatan = 1800)
2)
Trigonal
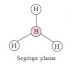
planar ( PEI + PEB = 3 ) 5) Oktahedral ( PEI + PEB = 6 )
3)
Tetrahedral ( PEI +
PEB = 4 )
Bentuk molekul berkaitan dengan susunan ruang atom-atom dalam molekul. Berikut ini bentuk geometri dari beberapa molekul.
Kita dapat menentukan bentuk molekul dari hasil percobaan maupun dengan cara meramalkan bentuk molekul melalui pemahaman struktur electron dalam molekul. Pada sub bab ini, kita akan membahas cara meramalkan bentuk molekul berdasarkan teori tolak-menolak elektron-elektron pada kulit luar atom pusatnya.
2.
LKPD
LEMBARAN KERJA PESERTA DIDIK
TEORI DOMAIN ELEKTRON
Tujuan : menentukan bentuk molekul CaCl2 , SF4
dan SF6 , CH4 berdasarkan teori domain
elektron
Alat dan bahan : pentul dan penghapus
Langkah
Kegiatan :
1.
Tentukan konfigurasi elektron
setiap atom
2.
Tentukan jumlah pasangan elektron
valensi setiap atom
3.
Tentukan jumlah pasangan
elektron yang berikatan
4.
Tentukan jumlah pasangan
elektron bebas
5.
Buatlah bentuk molekulnya dengan penghapus dan
pentul
6.
Lengkapilah tabel di bawah
No
|
Rumus Molekul
|
Jumlah Pasangan Elektron
|
Jumlah Pasangan Elektron
Ikatan
|
Jumlah Pasangan Elektron
Bebas
|
Bentuk Molekul
|
1
2
3
4
|
H2O
SF4
SF6
CH4
|
Kesimpulan :
3. Penilaian Pengetahuan
No
|
Nama
|
Penilaian KD 3.6
|
Nilai
Akhir
|
||
Tugas
|
UH
|
Produk
|
|||
4. Penilaian Keterampilan
LEMBAR PENGAMATAN PENILAIAN KETERAMPILAN
KD. 3.6
KELAS X IPA
No
|
Nama
|
Keterampilan
yang diamati dalam membuat tugas
|
|||
TW
|
TTW
|
L
|
TL
|
||
1
|
|||||
2
|
|||||
3
|
|||||
4
|
|||||
5
|
|||||
Keterangan
:
TW :
Tepat Waktu
TTW :
Tidak Tepat Waktu
L :
Lengkap
TL :
Tidak Lengkap
Memenuhi semua kriteria,
nilai =4, Kurang 1 kriteria, nilai = 3 dan seterusnya.
5. Instrumen
a. Soal
1. Diketahui
beberapa atom senyawa berikut 35,5Cl17, 2H1
32O16, 31P15, 14N7,
12C6, , dan 1H berikatan membentuk
molekul senyawa dibawah ini.
Senyawa
|
PEB
|
PEI
|
|
1.
|
CH4
|
0
|
4
|
2.
|
CCl4
|
0
|
4
|
3.
|
PCl3
|
1
|
3
|
4.
|
H2O
|
0
|
2
|
5.
|
NH3
|
2
|
2
|
Maka jumlah PEB dan PEI
senyawa yang benar adalah…
A. 1, 2,
3 C. 2, 3, 4 E. 3, 4, 5
B. 1, 3,
5 D. 2, 3, 5
2. Suatu
molekul mempunyai 4 pasang elektron di sekitar atom pusat, 2 diantaranya merupakan
PEB, maka bentuk molekul yang paling mungkin adalah ….
A. segitiga
datar
B. segiempat
planar
C. tetrahedron
D. bentuk
T
E. bentuk
V
3. Molekul H2O
memiliki domain elektron sebanyak….
a. 1 d. 4
b. 2 e. 5
c. 3
- Jelaskan jumlah PEB dan PEI dari
molekul NH3 jika diketahui nomor atom N=7 dan H=1!
- Lengkapi table di bawah ini
dengan benar!
No
|
Molekul
|
Jumlah Pasangan Elektron di Sekitar Atom Pusat
|
Bentuk Molekul
|
||
Total
|
Terikat
|
Tak terikat
|
|||
1
|
H2S
|
||||
2
|
Cl2O
|
||||
3
|
BF3
|
||||
4
|
PCl3
|
||||
5
|
SiCl4
|
||||
a. Pembahasan dan Penscoran
1. Kunci/pedoman
penskoran: A
2. Kunci/pedoman
penskoran: E
3. Kunci/pedoman
penskoran: D
4. Pedoman
penskoran:
No
|
Uraian
Jawaban
|
Skor
|
2.2
|
Konfigurasi
atom N: 2, 5
Konfigurasi
H : 1
Atom
N memerlukan 3 elektron lagi untuk membentuk 8 elektron kulit terluar,
sehingga atom N akan berikatan dengan 3 atom H membentuk NH3. Jika
3 pasang electron berikatan maka akan ada 1 pasang electron bebas.
|
10
|
Total
Skor
|
10
|
|
No
|
Uraian
Jawaban
|
Skor
|
|||||||||||||||||||||||||||||||||||||||
2.
|
|
Masing-masing
2
|
|||||||||||||||||||||||||||||||||||||||
Total
Skor
|
10
|
||||||||||||||||||||||||||||||||||||||||
Bukittinggi,
Mengetahui Guru Pengajar
Kepala SMA Muhammadiyah
Soal Sifat Koligatif Larutan (Kelas XII semester 1)
Silahkan jawab pertanyaan dibawah ini : Memuat...